Aufbau 원리는 전자가 원자 궤도에 어떻게 채워지는지 알려주는 기본 방법입니다. Aufbau 원리에 따르면 원자의 바닥 상태에서 전자를 채우는 것은 기본 패턴을 따릅니다. 이 원리는 모든 원자의 원자 궤도에 있는 전자가 에너지의 오름차순으로 채워지고 원자 궤도의 에너지를 찾기 위해 n+l 규칙을 따른다는 것을 알려줍니다.
구조원리
이 기사에서는 Aufbau 원리, Aufbau 원리의 특징, 예외 및 제한 사항에 대해 자세히 알아봅니다.
구조 원리 정의
Aufbau의 원리는 다음과 같습니다.
서로 다른 궤도에 있는 전자는 에너지가 증가하는 순서대로 채워집니다. 즉, 에너지가 가장 낮은 궤도가 먼저 채워지고 에너지가 가장 높은 궤도가 마지막에 채워집니다.
아우프바우(Aufbau)는 독일어로 '세우다'라는 뜻이다. 오비탈이 형성된다는 것은 오비탈에 전자가 채워지는 것을 의미합니다. 원자 궤도의 전자는 원자 궤도의 에너지가 오름차순으로 채워져 있음을 나타냅니다. 그리고 원자 오비탈의 에너지는 n+l 값이 높은 전자가 더 높은 에너지를 갖는다는 n+l 규칙을 사용하여 계산됩니다. 이전 줄에서 논의된 규칙에서, N Principal Quantum 번호를 알려줍니다. 엘 방위각 양자 번호를 알려줍니다.
두 개의 전자가 동일한 n+l 값을 갖는 경우 더 작은 값을 갖는 전자 N 에너지가 더 작아서 먼저 채워집니다. 원자 궤도에 전자를 채우는 순서는 아래에 설명되어 있습니다.
원리도의 구조
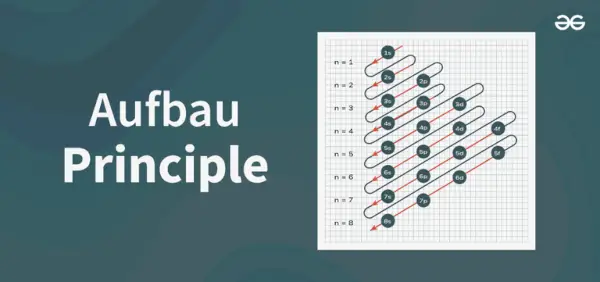
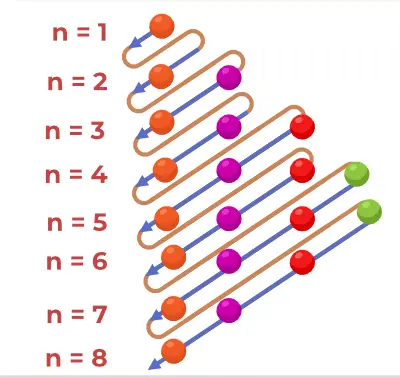
Aufbau 원리 다이어그램은 원자에 전자가 채워지는 순서를 묘사한 다이어그램입니다.
tostring 방법
원리도의 구조
원리공식의 구조
Aufbau 원리 공식은 원자 궤도에 전자가 채워지는 순서를 알려주는 공식입니다. 원자 궤도 공식은 다음과 같습니다.
1초, 2초, 2p, 3초, 3p, 4초, 3d, 4p, 5초, 4d, 5p, 6초, 4f, 5d, 6p, 7초, 5f, 6d, 7p…
원리 클래스 11의 구조
Aufbau 원리는 11학년 학생들에게 화학의 중요한 원리입니다. 이 원리는 다음과 같습니다.
원자의 원자 궤도에 있는 전자는 (n+l) 규칙을 사용하여 계산된 원자 궤도의 에너지가 오름차순으로 채워집니다.
구조 다이어그램 그리기
Aufbau 다이어그램은 아래에 추가된 단계를 사용하여 그려집니다.
- 원자에 채워질 전자의 수를 구하십시오.
- 우리는 원자에서
- s-오비탈은 최대 2개의 전자를 수용할 수 있습니다.
- p-오비탈은 최대 6개의 전자를 수용할 수 있습니다.
- d-오비탈은 최대 10개의 전자를 수용할 수 있습니다.
- f-오비탈은 최대 14개의 전자를 수용할 수 있습니다.
- 1s 오비탈의 처음 두 전자를 채웁니다.
- 그런 다음 n+l 규칙을 따르고 그에 따라 전자를 채웁니다.
구조원리의 두드러진 특징
Aufbau 원리의 다양한 특징은 다음과 같습니다.
- 궤도의 에너지는 주양자수(n)와 방위각 합수(I)의 합에 따라 달라집니다. 이것을 (n + l) 규칙 . 이 규칙에 따르면,
- 중성 고립 원자에서는 궤도의 (n + l) 값이 낮을수록 에너지가 낮아집니다. 그러나 서로 다른 두 종류의 오비탈이 동일한 값(n + l)을 갖는 경우 n 값이 낮은 오비탈의 에너지가 더 적습니다.
| 궤도의 종류 | n의 가치 | l의 가치 | n+l의 값 | 상대 에너지 |
|---|---|---|---|---|
| 1초 | 1 | 0 | 1+0 = 1 | 최저 에너지 |
| 2초 | 2 | 0 | 2+0 = 2 | 1s 오비탈보다 에너지가 높음 |
| 2p 3초 | 2 삼 | 1 0 | 2+1 = 3 3+0 = 3 | 2p 오비탈(n=2)은 3s(n=3) 오비탈보다 에너지가 낮습니다. |
| 3p 4초 | 삼 4 | 1 안드로이드용 이미지 메시지 게임 0 | 3+1 = 4 4+0 = 4 | 3p 오비탈(n=3)은 4s(n=4) 오비탈보다 에너지가 낮습니다. |
| 3d 4p | 삼 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d 오비탈(n=3)은 4p(n=4) 오비탈보다 에너지가 낮습니다. |
표에 주어진 설명에 따르면, 주양자수의 수가 증가함에 따라 다양한 오비탈의 에너지가 증가하는 것으로 나타났습니다.
- 따라서 전자가 원자 궤도에 채워지는 순서는 다음과 같습니다. 원자 이다, 1초, 2초, 2p, 3초, 3p, 4초, 3d, 4p, 5초, 4d, 5p, 6초, 4f, 5d, 6p, 7초, 5f, 6d, 7p...
Aufbau 원리를 이용한 전자 구성
그만큼 전자 구성 몇 가지 요소에 대해 Aufbau 원리를 사용하는 방법은 아래에 설명되어 있습니다.
황의 전자 구성
원자 번호 황의 수는 16입니다. 즉, 전자가 16개 있습니다.
이제 Aufbau 원리를 사용하여 유황의 전자 구성은 다음과 같이 작성됩니다.
[S] = 1초 2 2초 2 2p 6 3초 2 3p 4
질소의 전자 구성
질소의 원자 번호는 7입니다. 즉, 전자가 7개 있습니다.
이제 Aufbau 원리를 사용하여 질소의 전자 구성은 다음과 같이 작성됩니다.
[N] = 1초 2 2초 2 2p 삼
건설 원칙의 예외
크롬과 구리인 Aufbau 원칙에는 몇 가지 예외가 있습니다. 그들의 전자 구성은,
C의 난수 생성기
크롬의 전자 구성
Aufbau 원리에 따른 크롬의 전자 구성은 다음과 같아야 합니다.
- Cr(24): [Ar]3d 4 4초 2
그러나 실제 크롬(Cr)의 전자적 구성은,
- Cr(24): [Ar]3d 5 4초 1
이러한 전자 구성의 이유는 절반만 채워진 d 원자 궤도가 더 안정적입니다. Aufbau 원리에 따라 채워진 궤도보다.
구리의 전자 구성
Aufbau 원리에 따른 구리의 전자 구성은 다음과 같아야 합니다.
- Cu(29): [Ar]3d 9 4초 2
실제 Copper(Cu)의 전자적 구성은,
- Cu(29): [Ar]3d 10 4초 1
이러한 전자 구성의 이유는 가득 찬 d 원자 궤도가 더 안정적입니다. Aufbau 원리에 따라 채워진 궤도보다.
자세히 알아보기
구조 원리 – FAQ
화학의 Aufbau 원리는 무엇입니까?
화학의 Aufbau 원리는 모든 원자의 원자 궤도에 있는 전자를 채우는 데 사용되는 기본 원리입니다. 이 정리는 원자 궤도에 전자가 채워지는 순서를 알려줍니다.
누가 Aufbau 원칙을 주었나요?
Aufbau 원리는 덴마크의 유명한 물리학자 Niels Bohr가 1920년에 제시한 것입니다.
Pauli의 배제 원칙은 무엇입니까?
파울리의 배타 원리는 원자 내에서 4개의 양자수를 모두 갖는 전자가 2개도 없다는 것입니다. 티 그도 마찬가지다. 적어도 양자수 중 하나는 원자의 모든 전자에 대해 다릅니다.
n+l 규칙이란 무엇입니까?
n+l 법칙은 오비탈의 에너지가 주양자수(n)와 방위각양자수(l)의 합에 따라 결정된다는 법칙이다. 이 규칙을 (n+l) 규칙이라고 합니다.
Aufbau 원칙의 예외는 무엇입니까?
Aufbau 원칙의 예외는 다음과 같습니다.
- 크롬 Cr의 전자 구성[24]
- 구리 구리의 전자 구성[29]
