원자 궤도 수학적 함수인 는 원자 내 전자(또는 전자쌍)의 파동 거동을 설명합니다. 원자 궤도는 종류에 따라 모양이 다릅니다. 원자 궤도의 다양한 모양은 특정 방향에서 핵 주위에 전자를 찾을 확률이 가장 높거나 0임을 나타냅니다. 오비탈에는 네 가지 유형이 있으며 각각 모양이 다르고 문자 s, p, d 및 f로 표시됩니다. s 및 p 궤도는 화학 및 생물학적 화학에서 가장 풍부하기 때문에 고려됩니다. 안 s-궤도 중앙에 구형 핵이 있고, p-궤도 덤벨 모양이고 5개 중 4개는 d 궤도 클로버잎 모양이다. 다섯 번째 d 오비탈은 중앙에 도넛이 있는 긴 아령 모양입니다. 원자의 궤도는 층이나 전자 껍질로 구성됩니다.
원자 궤도는 무엇입니까?
원자 오비탈은 전자를 발견할 가능성이 최대인 원자핵 근처의 3차원 공간입니다.
양자 원자 모델에 따르면 원자는 무한한 수의 궤도를 가질 수 있습니다. 이러한 궤도는 크기, 모양 또는 방향에 따라 분류될 수 있습니다. 궤도가 좁을수록 핵에 가까운 전자를 잡을 확률이 더 높아집니다. 궤도파동함수는 전자의 좌표를 표현하는데 사용되는 수학적인 함수로 흔히 알려져 있다. 전자를 찾을 가능성은 궤도 파동 함수의 제곱으로 표시됩니다. 이 파동 함수는 경계면 다이어그램 생성에도 도움이 됩니다.
궤도파 함수
그만큼 양자 원자 모델 원자는 매우 다양한 궤도를 가질 수 있다고 예측합니다. 이러한 궤도는 크기, 기하학 또는 기울기에 따라 그룹화될 수 있습니다. 궤도 크기가 감소하면 핵에 가까운 전자를 얻을 확률이 높아집니다. 전자의 좌표를 나타내는 데 사용되는 수학 함수를 궤도파 함수 . 전자 발견 확률은 궤도 파동 함수의 제곱으로 표시됩니다.
또한 이 파동 함수를 사용하여 경계면 다이어그램을 만들 수도 있습니다. 다양한 오비탈에 대한 일정한 확률 밀도의 경계면 다이어그램을 사용하면 오비탈의 형태를 더 잘 이해할 수 있습니다.
원자 궤도의 모양
원자 궤도의 모양은 다양합니다. 즉, 핵을 둘러싸고 있는 전자의 확률 분포가 다릅니다. 서로 다른 궤도에 있는 전자가 모핵 주위의 서로 다른 영역에 위치할 가능성이 높으며 따라서 다양한 강도로 후자의 인력을 경험할 수 있다는 사실은 궤도의 에너지 범위가 넓은 이유 중 하나입니다. 주어진 수소 원자 껍질에 있는 모든 오비탈이 다양한 형태를 가지면서도 동일한 에너지를 갖는다는 것은 놀라운 일입니다. 이는 다양한 에너지 관련 기여가 제거되었기 때문입니다.
그러나 두 번째 전자가 생기자마자 축퇴 현상은 사라집니다.
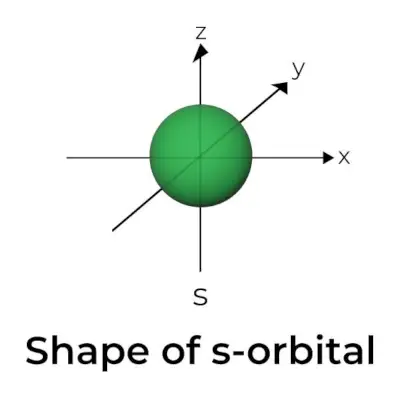
s-궤도의 모양
- s 궤도 경계면 다이어그램은 중심에 핵이 있는 구와 유사하며 2차원에서 원으로 표시할 수 있습니다.
- s-오비탈은 구형 대칭입니다. 이는 주어진 거리에서 전자를 찾을 확률이 모든 방향에서 동일하다는 것을 의미합니다.
- s 오비탈의 크기는 마찬가지로 1차 양자수(n)의 값이 증가함에 따라 증가하는 것으로 나타났습니다. 따라서 4초> 3초> 2초> 1초입니다.
- 노드 포인트는 전자를 찾을 가능성이 없는 위치입니다. 노드는 방사형 노드와 각도 노드의 두 가지 유형으로 분류됩니다. 핵으로부터의 거리는 방사형 노드에 의해 계산되는 반면 방향은 각도 노드에 의해 결정됩니다.
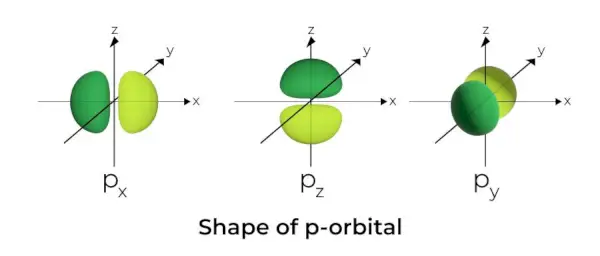
p-궤도의 모양
- p 오비탈은 아령처럼 형성됩니다.
- p 궤도 노드는 핵의 중심에 위치합니다.
- 3개의 오비탈이 있기 때문에 p 오비탈은 최대 6개의 전자를 차지할 수 있습니다.
- 각 p 오비탈은 핵을 가로지르는 평면의 양쪽에 위치한 로브라고 알려진 두 부분으로 구성됩니다.
- 각 p 오비탈에는 핵을 가로지르는 평면의 양쪽에 로브라고 알려진 부분이 있습니다. 두 엽이 교차하는 평면에서 전자를 발견할 가능성은 0입니다.
- 세 개의 오비탈은 크기, 모양, 에너지가 동일하기 때문에 축퇴 오비탈로 알려져 있습니다.
- 궤도 사이의 유일한 차이점은 돌출부의 방향입니다. 돌출부는 x, y 또는 z축을 따라 방향이 지정되므로 이름이 2로 지정됩니다.px, 2파이, 그리고 2pz. 공식 n –2는 노드 수를 계산하는 데 사용됩니다.
- s 오비탈과 마찬가지로 p 오비탈의 크기와 에너지는 1차 양자수가 증가함에 따라 증가합니다(4p> 3p> 2p).
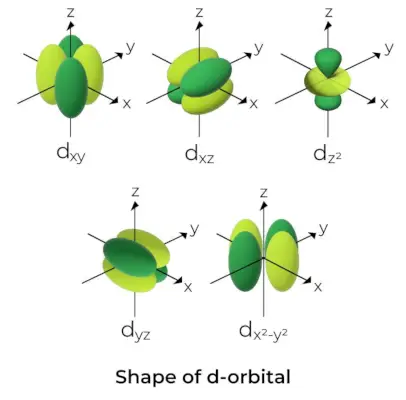
d-궤도의 모양
- d 궤도의 경우 자기 궤도 양자 수는 (-2,-1,0, 1,2)로 지정됩니다. 결과적으로 우리는 5개의 d-오비탈이 있다고 주장할 수 있습니다.
- 이 궤도는 기호 d로 표시됩니다.xy, 디yz, 디xz, 디엑스2-그리고2, 그리고 디와 함께2.
- 처음 4개의 d 오비탈의 형태는 서로 유사하지만 d와는 다릅니다.와 함께2그러나 다섯 개의 d 오비탈의 에너지는 모두 동일합니다.
f-궤도의 모양
- f 오비탈의 형태는 분산되어 있습니다. f 오비탈의 값이 l=3이므로 1차 양자수 n의 최소값은 4입니다.
- f 궤도에 해당하는 ml 값은 (-3,–2, –1, 0, +1, +2, +3)입니다.
- 결과적으로 l = 3인 경우 7개의 f 오비탈이 있습니다.

퇴화 궤도
축퇴 궤도는 동일한 에너지를 갖는 궤도입니다. 이러한 궤도는 서로 다릅니다(우주 주위의 공간에서는 서로 다른 방향으로 배치될 수 있음). 원자핵 ), 그러나 그들은 동일한 에너지를 가지고 있습니다. 외부 장의 존재 하에서 p 오비탈의 축퇴는 영향을 받지 않습니다. 그러나 f 및 d 오비탈의 축퇴는 시스템에 외부 필드(전기장 또는 자기장)를 적용하여 깨질 수 있습니다.
더 높은 에너지를 갖는 궤도는 거의 없지만 다른 궤도는 더 낮은 에너지를 갖습니다. 퇴화는 더 이상 시스템에 존재하지 않습니다. 예를 들어 d 오비탈은 모두 동일한 에너지를 갖는 5개의 축퇴 오비탈로 구성됩니다.
더 읽어보기:
- 분자 궤도 이론
- 원자의 궤도 채우기
- 이종 교잡
원자 궤도의 모양에 대한 FAQ
질문 1: 궤도는 어떻게 작동하나요?
답변:
원자 궤도함수는 원자이론과 양자역학에서 원자 내의 전자 하나 또는 전자쌍의 파동적인 행동을 표현하는 수학적 표현이다. 각 오비탈은 최대 2개의 전자를 차지하며 각각 고유한 양의 스핀을 갖습니다.
질문 2: 절점 평면(Nodal Plane)이란 무엇입니까?
답변:
전자를 발견할 확률이 무시할 수 있거나 0인 평면을 노드 평면(Nodal Plane)이라고 합니다.
질문 3: 오비탈은 몇 개 있나요?
답변:
한 달에 몇 주가 있나요?
s 하위 준위에는 궤도가 하나뿐이므로 전자는 두 개만 존재할 수 있습니다. p 하위 준위는 3개의 궤도로 구성되므로 최대 6개의 전자가 존재할 수 있습니다. d 하위 준위는 5개의 궤도로 구성되므로 최대 10개의 전자가 존재할 수 있습니다. 그리고 4개의 하위 수준 각각에는 최대 14개의 전자를 수용할 수 있는 7개의 궤도가 있습니다.
질문 4: 어떤 오비탈이 가장 높은 에너지를 가지고 있나요?
답변:
궤도 1이 가장 많은 에너지를 가지고 있습니다. 전자의 에너지는 원자의 전기 거품에서 전자를 꺼내는 데 필요한 에너지의 양입니다.
질문 5: 껍질과 궤도의 차이점은 무엇입니까?
답변:
원자에서 껍질은 동일한 양자수 이론 n의 하위 껍질 모음입니다. 오비탈에는 각각 2개의 전자가 있으며, 같은 오비탈에 있는 전자는 크기, 각운동량 크기, 자기양자수 정의가 동일합니다.
질문 6: 시그마와 파이 본드가 무엇인가요?
답변:
원자 궤도 중첩은 시그마 및 파이 결합을 생성합니다. 시그마 결합은 원자 궤도엽이 겹쳐서 생성되는 반면, Pi 결합은 하나의 원자 궤도엽이 다른 원자 궤도엽과 겹칠 때 생성됩니다.
